自2019年末新冠疫情爆发以来,持续性蔓延已造成全球170,812,850人感染,3,557,586 人死亡(截至2021年6月2日)。
新冠病毒(SARS-CoV-2)可通过飞沫、直接接触,在人与人之间快速传播,造成大面积感染。
那么它对动物的传染能力是怎样的呢?
2020年4月5日,美国纽约布朗克斯动物园时年4岁的马来亚虎Nadia被检测出感染新冠病毒,这是美国首例被报道的非人动物感染新冠病毒的案例,受到广泛关注。

纽约布朗克斯动物园首例感染新冠病毒的老虎Nadia(图片来源:newsroom.wcs.org)
布朗克斯动物园在3月中旬已关闭,而患病老虎Nadia于2020年3月27日出现相关症状,园内其他4只老虎与3只非洲狮也相继出现了呼吸系统疾病。
考虑到对这些猛兽采样需全身麻醉,除Nadia外的其余猛兽采用了粪便采样测试。
美国农业部国家兽医服务实验室推断Nadia是被亲密接触的动物饲养员所传染。
除了老虎、狮子,美国动物园和保护区里的雪豹、大猩猩也被检测出感染新冠病毒。
在许多情况下,即便感染新冠病毒的饲养员穿着防护服,遵循新冠肺炎防护措施,动物们依然可能被传染。

USDA——美国动物感染新冠病毒案例分布(截至2021年6月2日)(图片来源:aphis.usda.gov)
因此,相关部门给出指导意见,患病人群需禁止和宠物密切接触,并对宠物实行和人一样的隔离。
但目前,对动物的大面积筛查尚不可行。
中国香港于2020年3月初公布了第一例宠物狗的感染事件。香港农业渔业保护署在2月27日、3月19日分别检测出一例狗的新冠病毒阳性,都疑似被主人传染。
截至2021年5月31日,已公开的动物新冠病毒感染事件已遍及全球30个国家/地区,主要分布在欧洲和美洲。
出现频率最高的为猫、狗、水貂感染,可能与这些动物和人频繁密切接触相关。

世界动物健康组织发布的新冠病毒动物感染数量的全球分布(截至2021年5月31日)(图片来源:oie.int)
新冠肺炎患病人群可通过密切接触传染其他动物,那么在此过程中是否有潜在的易感宿主?
从2020年4月开始,水貂成为了最引人注目的感染对象。感染事件主要发生在欧美国家:
荷兰自2020年4月23日至2020年12月5日共计69个水貂养殖场的水貂被检测出新冠病毒感染,超过该国养殖场总数的1/3;
2020年5月西班牙东北部阿拉贡自治区一水貂养殖场7名员工被检测出感染新冠病毒,随后陆续检测发现大部分水貂呈新冠病毒阳性;
丹麦自2020年6月中旬出现水貂感染,截至2020年12月7日共计290个农场受到新冠病毒侵袭,约占该国水貂养殖场总数的1/4;
美国从2020年7月底至年底,已有16000+水貂死于新冠病毒感染,包括犹他州、密歇根州、威斯康星州以及俄勒冈州。十多个养殖场被隔离研究。
2020年12月8日、23日,加拿大的不列颠哥伦比亚省在两个水貂养殖厂内确认了新冠病毒的传播,其中第一个养殖场起因是8名员工的确诊;
大面积的水貂感染不禁引起人们的好奇,甚至有些恐慌。对水貂感染新冠病毒的系统分析研究在全球陆续展开。
首先,和人类似,感染新冠病毒的水貂在症状上出现了分化。
虽然大部分水貂(尤其是年龄较老的)感染后出现与人类似的症状:精神/食欲不振、呼吸道症状、流鼻涕、打喷嚏等,而有的新冠病毒阳性水貂却并无明显症状。
因此,仅从外在表现难以断定水貂是否已经感染。
除了流行病学数据,病毒基因组数据也是研究水貂新冠病毒来源和变异特征的重要基础。
根据中国国家生物信息中心新型冠状病毒信息库2019nCoVR的统计,截至2021年6月2日,国际上已发布近1000条水貂来源的新冠病毒基因组信息。
其中661条来源于美洲水貂(Neovison vison),280条来源于欧洲水貂(Mustela lutreola),以及水貂类型尚不明确的7条序列(Mink)。另外,还有4条来源于雪貂(Mustela putorius furo)。
数据库中收录了世界各地来源的新冠病毒基因组数据,并提供多项质量评估指标以及变异注释。谱系分析显示水貂携带的新冠病毒主要分布在欧洲的B.1.1.298、B.1.8、B.1等支系。
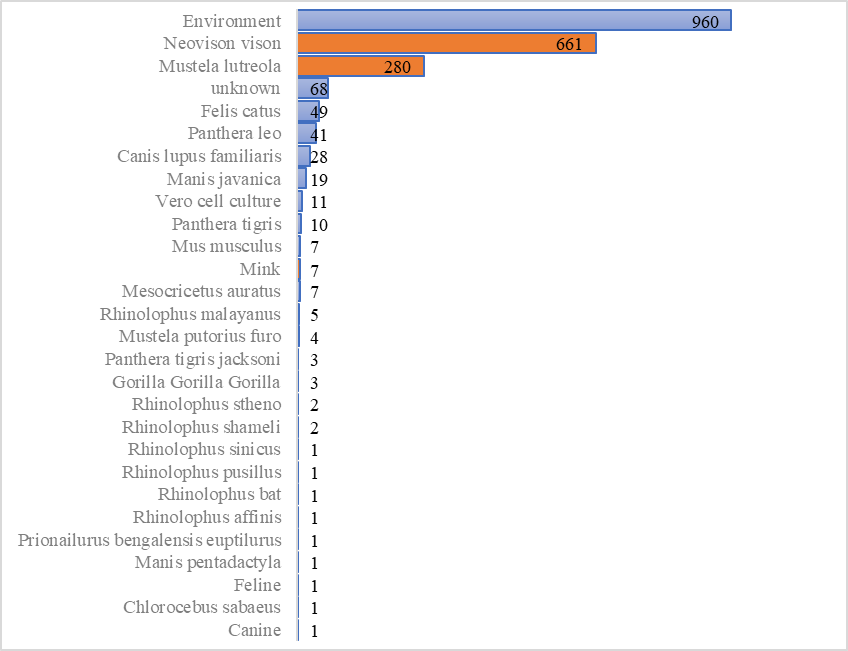
非人源的新冠病毒基因组数量分布(统计数据来源于国家生物信息中心新冠信息库2019nCoVR,截至2021年6月2日)
根据流行病学和基因组学研究,多数案例中水貂是被人传染,进而在水貂之间传播。
已发现的水貂感染事件主要发生在养殖场,或与养殖场相关。
2020年12月,美国犹他州发现一只新冠病毒阳性的野生水貂,无明显症状,但该水貂于一座新冠病毒感染的养殖场附近被发现。分析发现,其病毒基因组序列与养殖场内分离获得的病毒基因组序列无差别。
同时,俄勒冈州有2只水貂被检测出感染,疑似为养殖场出逃而非野生。
目前,尚未报道自然界中自由生活的动物之间的新冠病毒传播。
水貂中已发现了三种传染类型,早期的人传水貂、水貂之间传染,和之后出现的貂传人。
貂传人事件在荷兰、丹麦、波兰已经发生,以及美国密歇根农场。
2020年6月起,丹麦陆续检测出水貂相关的人感染事件,大多数发生于水貂养殖场密集的北日德兰大区。
鉴定貂传人的关键在于分析病毒基因组中是否含有水貂相关的变异。
虽然对丹麦及荷兰的水貂新冠基因组的聚类显示出不同的人类传染源,但是这些病毒却在水貂内出现了共有的变异。
在目前划分出的5个水貂新冠变异株类别中,均包含有Y453F突变。
2020年11月5日,丹麦血清研究所发表的一篇报告显示,在6月上旬至10月中旬该国发生的37,967例感染中,5102例(13%)被抽样进行了基因组测序;其中214例(4.2%)与水貂相关,它们都含有Y453F突变,并且其中的12例为“cluster 5”类型(见下文)。
2021年初,丹麦鉴定出的水貂相关病例已达1000例,估算真实的水貂相关病例或已超过4000。
新冠病毒很可能通过在动物间大量传播,发生新的变异或出现新的变异组合,导致病毒传染能力增强以及对疫苗敏感性降低等不利情况。
在丹麦的动物疫情中,科学家发现水貂来源的新冠病毒发生了人源新冠病毒没有的变异类型,其中“cluster 5”变异类型受到特别关注。
该类型毒株的S蛋白在前述Y453F突变的基础上,还具有I692V、M1229I、S1147L突变以及一个包含69和70两个位置的氨基酸缺失。
研究表明该类型病毒株“对中和抗体的敏感性有所降低”,将有可能导致正在生产的疫苗对其失效。
变异影响疫苗效果是最为让人担忧的。

人-水貂-人的传染路线演生新的病毒株变异类型 (图片来源于网络)
为了防止/抑制貂传人的发生以及更为严重的后果,相关国家纷纷采取行动控制疫情在水貂中的扩散,其中最主要的手段便是对水貂的扑杀。
据统计,荷兰已扑杀超150万只水貂,西班牙扑杀近10万只。而水貂感染最严重的丹麦在2020年10月末下达政令宣布扑杀该国范围内的所有养殖水貂,据统计数量为1500-1700万只。该举措曾引起诸多从业者的不满和抗议。
目前,丹麦全境内的水貂已经几乎扑杀完毕。丹麦作为世界首屈一指的水貂毛皮生产地,停止水貂养殖产业意味着巨大的经济损失。
据2020年12月通过的一项法案,截至2021年底,丹麦不再允许水貂养殖。此外,丹麦总理为了防止变异株在人之间传播,曾于2020年11月6日下达西北地区的封城令。
随着全国范围内的水貂扑杀行动开展,水貂变异株在人群中的比例明显下降,“cluster 5”自2020年9月以来也尚未出现新的案例。
水貂在新冠病毒疫情中付出了惨痛代价。我们不禁思考,新冠病毒为何会在水貂中大面积传播?这是偶然事件吗?
水貂的近亲——雪貂,长期以来作为呼吸系统传染性疾病的模式生物,在研究致病机理、传染模式以及疫苗评估方面都发挥着重要作用。
科学家们曾借助雪貂模型对包括禽流感、冠状病毒、尼帕病毒和麻疹病毒等在内的病毒进行研究。
雪貂身形较小,其呼吸道的分布、肺的质地、结构也与人类似,并且在呼吸系统疾病反应中展现出诸多类人的临床特征。

雪貂具有与人类似的呼吸系统临床症状(图片来源:Belser et al., Microbiol Mol Biol Rev, 2016.)
另外,早在2020年3月,哈尔滨兽医研究所对雪貂、猫、狗等家畜家禽进行了新冠病毒易感性研究。
实验结果表明,新冠病毒在狗、猪、鸡、鸭体内复制能力微弱,但很容易感染雪貂和猫。
由于水貂和雪貂是近亲,两者同属鼬科(还包括黄鼠狼、水獭等),其对病毒的易感性、病理反应也比较相似。再加上人为的大量高密度养殖,使得新冠病毒在水貂之间的传播变得容易。
另外,2020年1月24日,在新冠病毒疫情爆发初期,有团队通过用深度学习的方法预测新冠病毒的潜在动物宿主,发现蝙蝠和水貂的病毒感染模式最接近,水貂可能成为新冠病毒的感染对象。
是否可对水貂进行新冠病毒预防成为大家关注的一个重要问题。
2020年12月8日,哈尔滨兽医研究所发现新冠病毒在水貂上下呼吸道都能高效复制,并能通过飞沫在水貂之间高效传播,造成与人相似的肺部病理损伤。
进一步研究发现基于新冠病毒S蛋白的疫苗可以成功降低病毒在水貂呼吸道的复制能力并阻止肺部损伤。

新冠病毒结构示意图(图片来源:Kim et al., Cell, 2020.)
SARS-CoV-2病毒颗粒主要由核酸(gRNA)、核衣壳蛋白(N蛋白)、跨膜蛋白(M蛋白)、包膜蛋白(E蛋白)和刺突(S蛋白)构成,此外还包括一些辅助蛋白。
S蛋白是由同源三聚体构成的刺突,在病毒侵染细胞时发挥关键识别功能。
新冠病毒的S蛋白通过结合细胞表面的血管紧张素转化酶2(ACE2)进入细胞,完成特异性识别和侵染。
S蛋白上的受体结合结构域(RBD)是S蛋白与ACE2结合的核心区域,RBD上的变异以及变异所引起的亲和力改变往往也是人们研究的重点之一。
探究S蛋白-宿主ACE2结合可提示潜在的新冠病毒宿主。
事实上,ACE2普遍存在于脊椎动物中,而且哺乳动物中的ACE2高度相似,多种哺乳动物可能是潜在的新冠病毒宿主。
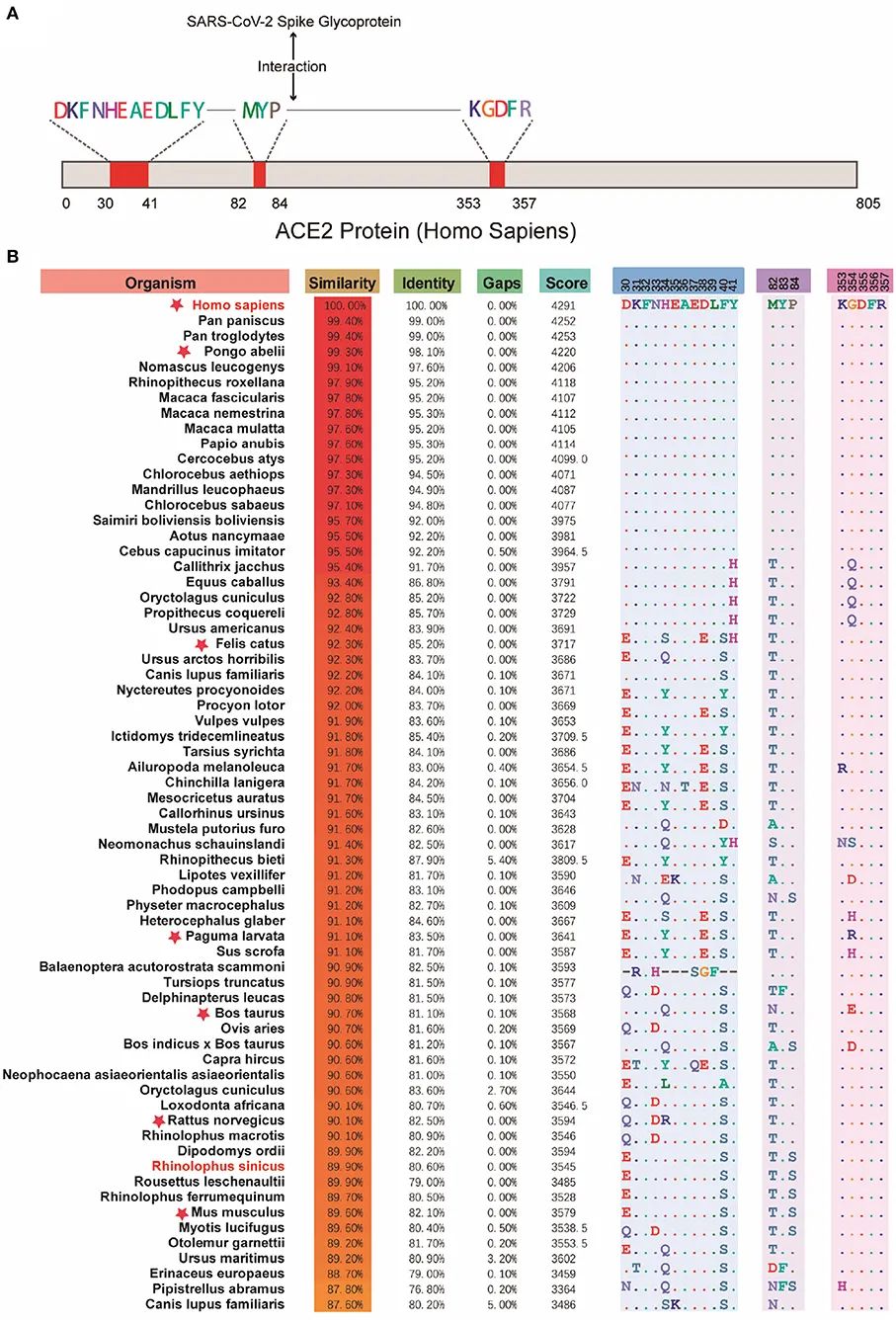
人类ACE2与SARS-CoV-2结合区域(A);不同物种ACE2相似度比较(B)(图片来源:Cao et al., Front Vet Sci, 2020.)
可以看出,类人猿往往与人类ACE2相似度较高。并且鉴于其生理结构等特征也最接近于人,它们很可能也是新冠病毒易感的宿主。
因此,非洲的一些国家卢旺达、乌干达和刚果金早在2020年3、4月份,就相继宣布停止一切大猩猩保护区的旅游观光活动。
病毒对某一物种的侵染能力以及在该物种中的传染能力由诸多因素决定,如该物种的生理结构、病毒-宿主免疫反应等。
对这些因素的解析比较复杂,涉及具体发病机制的探究大多借由活体实验完成。
自然界非人动物种类复杂多样,实验室的动物感染研究对于评估和预测感染形势十分必要。
实验研究表明,许多哺乳动物,包括猫、狗、河堤田鼠、雪貂、果蝠、仓鼠、水貂、猪、兔子、浣熊狗、树鼩、白尾鹿,均能感染新冠病毒。
猫、雪貂、果蝠、仓鼠、浣熊狗、白尾鹿能在实验室条件下将新冠病毒传染给同类动物。
对于非人灵长类动物,恒河猴、食蟹猴、狒狒、绿猴、普通的狨猴,在实验室环境中会感染新冠病毒并患病。
实验用的小鼠、鸡、鸭似乎没有感染新冠病毒或传播该病毒。
至于水貂,尽管已在全球多个国家发生大面积感染,尚无证据表明它们对人类的新冠病毒感染有重要影响。
水貂感染事件主要发生在农场。感染的水貂除了可传染同类,还能传染农场的猫、狗等动物,以及在农场的工人。因此,水貂饲养场的工人和周边人员有必要加强防护。
最后,关于新冠病毒的非人动物传播,已经清楚的还不多,更多内容属于尚未明确和有待研究。
例如,新冠肺炎是否以及如何影响不同的动物?动物对新冠病毒在人群间的传播有何影响?面对疫情,我们不仅需要迅速开展防疫工作,对病毒传染、发病机制的各项研究也是我们不可或缺的重要武器。
[1] https://covid19.who.int/
[2] https://newsroom.wcs.org/News-Releases/articleType/ArticleView/articleId/14084/Update-Bronx-Zoo-Tigers-and-Lions-Recovering-from-COVID-19.aspx
[3] https://www.aphis.usda.gov/aphis/dashboards/tableau/sars-dashboard
[4] https://www.oie.int/en/what-we-offer/emergency-and-resilience/covid-19/
[5] https://www.rijksoverheid.nl/actueel/nieuws/2020/11/05/nieuwe-besmetting-covid-19-bij-nertsenbedrijf
[6] European Food Safety, A., European Centre for Disease, P., Control, Boklund, A., Gortazar, C., Pasquali, P., Roberts, H., Nielsen, S.S., Stahl, K., Stegeman, A. et al. (2021) Monitoring of SARS-CoV-2 infection in mustelids. EFSA J, 19, e06459.
[7] European Centre for Disease Prevention and Control. Detection of new SARS-CoV-2 variants related to mink. 12 November 2020. ECDC: Stockholm; 2020.
[8] https://bigd.big.ac.cn/ncov/ (2019nCoVR)
[9] https://apnews.com/article/wildlife-animals-health-coronavirus-pandemic-oregon-6566863ee2015ff4997cd41627a71402
[10] https://www.who.int/csr/don/06-november-2020-mink-associated-sars-cov2-denmark/zh/
[11] Johnson-Delaney, C.A. and Orosz, S.E. (2011) Ferret respiratory system: clinical anatomy, physiology, and disease. Vet Clin North Am Exot Anim Pract, 14, 357-367, vii.
[12] Belser, J.A., Eckert, A.M., Tumpey, T.M. and Maines, T.R. (2016) Complexities in Ferret Influenza Virus Pathogenesis and Transmission Models. Microbiol Mol Biol Rev, 80, 733-744.
[13] Shi, J., Wen, Z., Zhong, G., Yang, H., Wang, C., Huang, B., Liu, R., He, X., Shuai, L., Sun, Z. et al. (2020) Susceptibility of ferrets, cats, dogs, and other domesticated animals to SARS-coronavirus 2. Science, 368, 1016-1020.
[14] https://www.biorxiv.org/content/10.1101/2020.01.21.914044v4
[15] Shuai, L., Zhong, G., Yuan, Q., Wen, Z., Wang, C., He, X., Liu, R., Wang, J., Zhao, Q., Liu, Y. et al. (2021) Replication, pathogenicity, and transmission of SARS-CoV-2 in minks. National Science Review, 8.
[16] Kim, D., Lee, J.Y., Yang, J.S., Kim, J.W., Kim, V.N. and Chang, H. (2020) The Architecture of SARS-CoV-2 Transcriptome. Cell, 181, 914-921 e910.
[17] Cao, Y., Sun, Y., Tian, X., Bai, Z., Gong, Y., Qi, J., Liu, D., Liu, W. and Li, J. (2020) Analysis of ACE2 Gene-Encoded Proteins Across Mammalian Species. Front Vet Sci, 7, 457.
[18] https://www.cdc.gov/coronavirus/2019-ncov/daily-life-coping/animals.html